KVNachrichten




Verbandmittel und sonstige Produkte zur Wundbehandlung - Kennzeichnung verordnungsfähiger Produkte in der Verordnungssoftware
Die eindeutige Kennzeichnung der Verbandmittel und sonstigen Produkte zur Wundversorgung (sPzW) in der Artikelinformation sorgt in der Praxisverwaltungssoftware (PVS) zukünftig für die nötige Klarheit für die Beurteilung der Verordnungsfähigkeit konkreter Artikel. Nach §131 Abs. 5 SGB V ist diese Kennzeichnung verbindlich.
Aus dem Kennzeichen „Verordnungsfähiges Verbandmittel nach §31 Absatz 1a SGB V“ in der Artikelinformation kann abgeleitet werden, dass eine Verordnungsfähigkeit zu Lasten der GKV besteht. Dieses Kennzeichen erhalten alle Verbandmittel sowie vorübergehend diejenigen Produkte, die aufgrund der verlängerten Übergangsfrist derzeit noch verordnungsfähig sind.
Wir empfehlen die regelmäßige Aktualisierung der PVS, da Hersteller der betroffenen Produkte aktuell häufiger Änderungen bei den Angaben vornehmen. Die Kennzeichnung erfolgt wie in der Tabelle dargestellt:
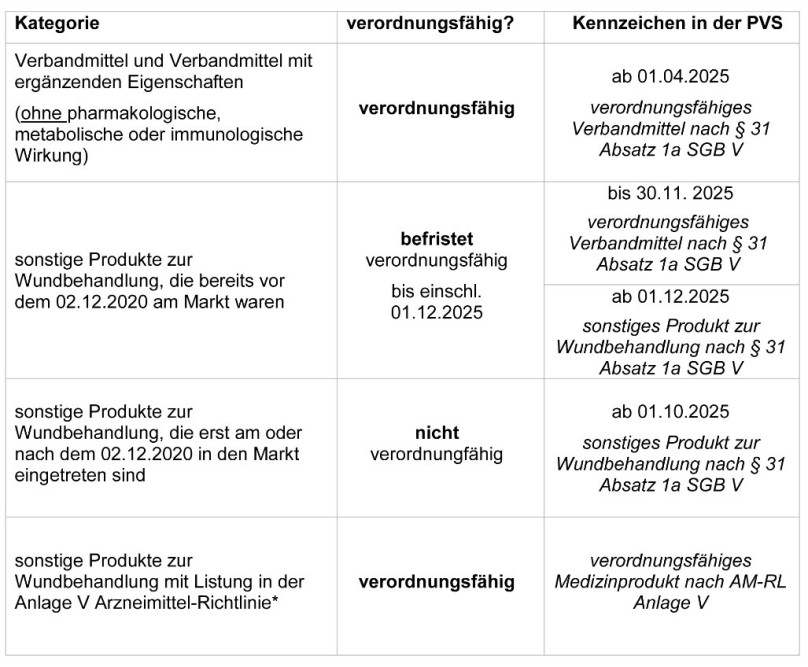
Das Kennzeichen „verordnungsfähiges Verbandmittel nach §31 Absatz 1a SGB V“ erhalten neben den „echten“ Verbandmitteln vorübergehend auch die nach der Übergangsregelung verordnungsfähigen sPzW. Diese Maßnahme ist ausschließlich technischen Gegebenheiten geschuldet, um so behelfsweise die befristete Verordnungsfähigkeit zu markieren. Das Kennzeichen für diese sPzW wechselt dann mit der Datenlieferung zum 1. Dezember 2025 in den Systemen auf „sonstiges Produkt zur Wundbehandlung nach §31 Abs. 1a SGB V“. Zum 1. Oktober 2025 soll außerdem bereits die Kennzeichnung der übrigen sonstigen Produkte zur Wundbehandlung in der Artikelinformation technisch umgesetzt sein.
*SPzW gelten gem. Anlage Va Arzneimittel-Richtlinie als nicht verordnungsfähig, da sie keine Verbandmittel sind. Nach einer positiven Bewertung durch den G-BA können einzelne sPzW jedoch auf Antrag namentlich in der Anlage V Arzneimittel-Richtlinie (verordnungsfähige Medizinprodukte) geführt sein und wären dann entsprechend gekennzeichnet. Dies gilt unabhängig vom Zeitpunkt des Inverkehrbringens.
